
เมื่อวันที่ 7 มกราคม 2565 องค์การอาหารและยาสหรัฐอเมริกา (Food and Drug Administration, FDA) อนุมัติการใช้ยา daridorexant สำหรับการรักษาโรคนอนไม่หลับในผู้ใหญ่ โดยยามีฤทธิ์เป็น dual orexin receptor antagonist ซึ่งมีผลช่วยลดความตื่นตัวที่มากเกินไปในผู้ป่วยโรคนอนไม่หลับ (insomnia) ทั้งนี้ ผู้วิจัยคาดว่าผู้ป่วยที่ได้รับยาชนิดนี้มีโอกาสเกิดอาการไม่พึงประสงค์น้อยกว่ายารักษาโรคนอนไม่หลับชนิดอื่นที่ใช้ในปัจจุบัน อาทิ อาการง่วงในตอนเช้า ทำงานช้าลงในช่วงกลางวัน หรืออาการปวดศีรษะ ซึ่งอาจพบได้จากการใช้ยากลุ่ม benzodiazepines, melatonin receptor antagonists หรือ nonbenzodiazepine sedative-hypnotics ทำให้เสี่ยงต่อการเกิดอันตรายขณะได้รับยาจึงต้องเลี่ยงพฤติกรรมหรือการทำงานบางอย่าง เช่น การขับขี่ยานพาหนะ หรือทำงานกับเครื่องจักร
การกระตุ้น orexin receptor ซึ่งพบมากที่สมองส่วนไฮโพทาลามัสมีผลทำให้ร่างกายเกิดการตื่นตัว เมื่อมีการทำงานผิดปกติหรือมีการกระตุ้นมากกว่าปกติจะส่งผลกระทบต่อวงรอบการนอนหลับและอาจทำให้เกิดโรคนอนไม่หลับได้ มีการพัฒนายาที่มีฤทธิ์เป็น dual orexin receptor antagonist ออกมาก่อนหน้านี้แล้ว โดยยาที่ FDA อนุมัติให้ใช้รักษาโรคนอนไม่หลับมี 2 รายการ ได้แก่ suvorexant และ lemborexant แต่ยาทั้งสองรายการยังคงมีอาการไม่พึงประสงค์ที่พบได้บ่อยเช่นเดียวกับยารักษาโรคนอนไม่หลับชนิดอื่น นั่นคือ อาการง่วงนอน และปวดศีรษะ แม้คุณสมบัติทางเภสัชจลนศาสตร์ของยา daridorexant มีความใกล้เคียงกับยา 2 รายการข้างต้น ทว่ามีค่าครึ่งชีวิตสั้นกว่า โดย suvorexant มีค่าครึ่งชีวิตเท่ากับ 12 ชั่วโมง lemborexant มีค่าครึ่งชีวิต 17-19 ชั่วโมง ขณะที่ daridorexant มีค่าครึ่งชีวิตอยู่ที่ 8 ชั่วโมง
ข้อมูลด้านประสิทธิภาพและความปลอดภัยของยา daridorexant ได้มาจากงานวิจัย 2 ชิ้นที่มีรูปแบบเป็น double-blind, parallel-group, phase 3 ซึ่งทำการศึกษาผู้ป่วยโรคนอนไม่หลับที่มีอาการระดับปานกลางถึงรุนแรงที่มีอายุตั้งแต่ 18 ปีขึ้นไป และมีประวัติการรายงานถึงปัญหาการนอนไม่หลับที่รบกวนชีวิตประจำวันอย่างน้อย 3 คืน/สัปดาห์ เป็นเวลานานอย่างน้อย 3 เดือน
งานวิจัยชิ้นที่ 1 ทำการแบ่งกลุ่มผู้ป่วยอย่างสุ่มจากทั้งหมด 930 ราย ออกเป็น 3 กลุ่มเท่า ๆ กัน โดยกลุ่มที่ 1 ได้รับยา daridorexant ขนาด 25 มิลลิกรัม กลุ่มที่ 2 ได้รับยา daridorexant ขนาด 50 มิลลิกรัม และกลุ่มที่ 3 ได้รับยาหลอก ส่วนงานวิจัยชิ้นที่ 2 ทำการแบ่งกลุ่มผู้ป่วยอย่างสุ่มจากทั้งหมด 924 ราย ออกเป็น 3 กลุ่มเท่า ๆ กันเช่นเดียวกัน แตกต่างกันตรงที่กลุ่มที่ 1 ได้รับยาขนาด 10 มิลลิกรัม กลุ่มที่ 2 ได้รับยา 25 มิลลิกรัม และกลุ่มที่ 3 ได้รับยาหลอก โดยในแต่ละงานวิจัยผู้ป่วยมากกว่า 2 ใน 3 เป็นผู้หญิง และร้อยละ 39 มีอายุตั้งแต่ 65 ปีขึ้นไป และลักษณะทางประชากรศาสตร์ระหว่างผู้ป่วยแต่ละกลุ่มมีความใกล้เคียงกัน
มีการตรวจการนอนหลับ (polysomnography, PSG2) ติดต่อกัน 2 คืนก่อนการวิจัย และอีก 2 ครั้ง คือ หลังได้รับยาครบ 1 เดือน และ 3 เดือน ตามลำดับ และให้ผู้ร่วมวิจัยทำแบบสอบถาม Insomnia Daytime Symptoms and Impacts Questionnaire (IDSIQ) ทุกวัน เพื่อประเมินความบกพร่องในเวลากลางวัน (daytime impairment) ที่สัมพันธ์กับโรคนอนไม่หลับ โดยแบบสอบถามให้ความสำคัญกับการนอนหลับ (sleepiness) อารมณ์ (mood) ความตื่นตัว (alertness) และการรับรู้ (cognition)
ผลลัพธ์หลัก (primary outcome) ของงานวิจัย คือ การวัดความเปลี่ยนแปลงของการตื่นตัวหลังนอนหลับ (wake after sleep onset, WASO) และระยะเวลาตั้งแต่เข้านอนจนถึงช่วงที่นอนหลับได้นาน (latency to persistent sleep, LPS) หลังผู้ป่วยได้รับยาหรือยาหลอกครบ 1 เดือน และ 3 เดือน ส่วนผลลัพธ์รอง คือ การวัดความเปลี่ยนแปลงของระยะเวลานอนทั้งหมดที่รายงานโดยผู้ป่วย (self-reported total sleep time, sTST) และคะแนนหัวข้อการนอนหลับจากแบบประเมิน IDSIQ (IDSIQ sleepiness domain score) หลังได้รับยาหรือยาหลอกครบ 1 เดือน และ 3 เดือน
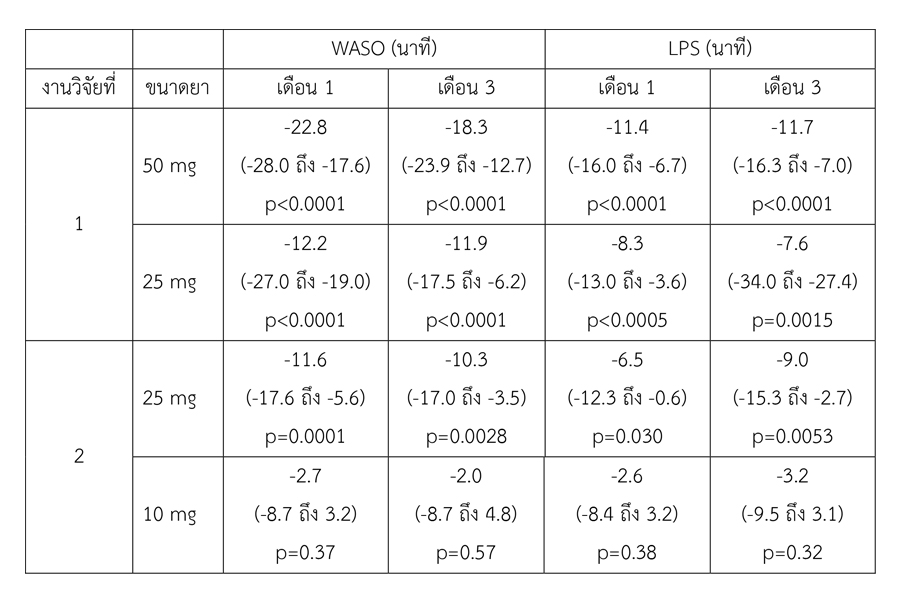
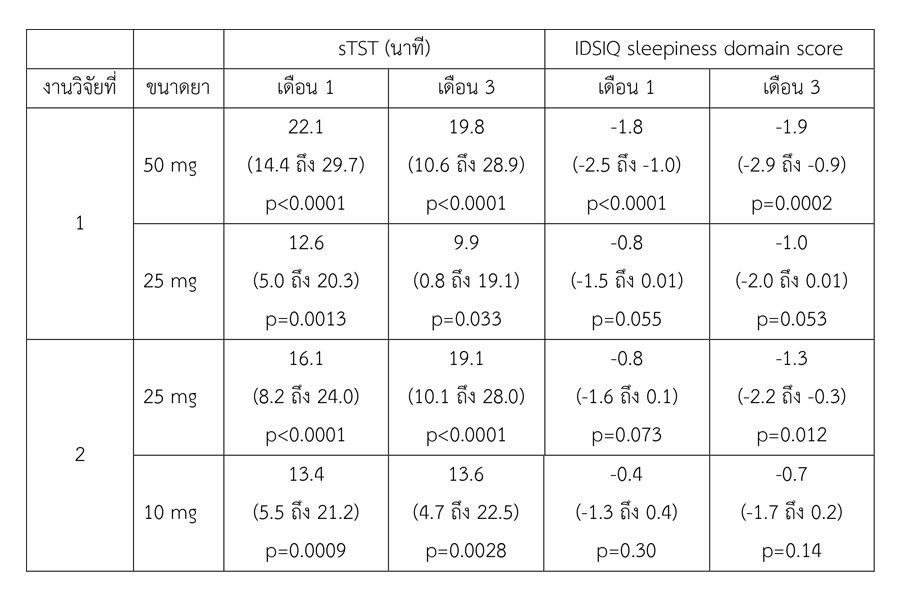
ผลลัพธ์งานวิจัยเมื่อครบ 1 เดือน งานวิจัยชิ้นที่ 1 พบว่า ค่า WASO ลดลง 22.8 นาที (p < 0.0001) และลดลง 12.2 นาที (p < 0.0001) สำหรับกลุ่มที่ได้รับยาขนาด 50 และ 25 มิลลิกรัม ตามลำดับ และหลังครบ 3 เดือน พบว่า ค่า WASO ลดลง 18.3 นาที (p < 0.0001) และลดลง 11.9 นาที (p < 0.0001) สำหรับกลุ่มที่ได้รับยาขนาด 50 และ 25 มิลลิกรัม ตามลำดับ ทั้งนี้ เมื่อเปรียบเทียบกับกลุ่มที่ได้รับยาหลอก พบว่า ค่า LPS ในกลุ่มที่ได้รับยาขนาด 50 มิลลิกรัม ลดลง 11.4 นาที (p < 0.0001) หลังครบ 1 เดือน และลดลง 11.7 นาที (p < 0.0001) หลังครบ 3 เดือน ส่วนกลุ่มที่ได้รับยาขนาด 25 มิลลิกรัม ค่า LPS ลดลง 8.3 นาที (p = 0.0005) และลดลง 7.6 นาที (p = 0.0015) หลังได้รับยาครบ 1 เดือน และ 3 เดือน ตามลำดับ ทั้งกลุ่มที่ได้รับยาขนาด 25 และ 50 มิลลิกรัม พบว่า sTST เพิ่มขึ้นอย่างมีนัยสำคัญ ขณะที่ IDSIQ sleepiness domain score ดีขึ้นในผู้ป่วยทั้งสองกลุ่ม แต่ผลลัพธ์มีนัยสำคัญเฉพาะกลุ่มที่ได้รับยาขนาด 50 มิลลิกรัม
สำหรับงานวิจัยชิ้นที่ 2 พบว่าผู้ป่วยกลุ่มที่ได้รับยาขนาด 25 มิลลิกรัม มีค่า WASO ลดลงอย่างมีนัยสำคัญเมื่อเปรียบเทียบกับกลุ่มที่ได้รับยาหลอกโดยลดลง 11.6 นาที หลังครบ 1 เดือน (p = 0.001) และ 10.3 นาที (p = 0.0028) หลังครบ 3 เดือน อย่างไรก็ตาม การได้รับยาขนาด 25 มิลลิกรัม ไม่สัมพันธ์กับความแตกต่างอย่างมีนัยสำคัญของค่า LPS ทั้งที่ 1 และ 3 เดือน ในส่วนของผลลัพธ์รอง พบว่า การได้รับยาขนาด 25 มิลลิกรัมสัมพันธ์กับ sTST ที่ดีขึ้น แต่ไม่สัมพันธ์กับ IDSIQ sleepiness domain score ขณะที่การได้รับยาขนาด 10 มิลลิกรัมไม่สัมพันธ์กับความเปลี่ยนแปลงของผลลัพธ์ใด ๆ เมื่อเปรียบเทียบกับกลุ่มที่ได้รับยาหลอก
ตารางที่ 1 แสดงผลลัพธ์หลัก (primary outcome) ได้แก่ ความเปลี่ยนแปลงของการตื่นตัวหลังนอนหลับ (wake after sleep onset, WASO) และระยะเวลาตั้งแต่เข้านอนจนถึงช่วงที่นอนหลับ ได้นาน (latency to persistent sleep, LPS)
ตารางที่ 2 แสดงผลลัพธ์รอง (secondary outcome) ได้แก่ ความเปลี่ยนแปลงของระยะเวลานอนทั้งหมดที่รายงานโดยผู้ป่วย (self-reported total sleep time, sTST) และคะแนนหัวข้อการนอนหลับจากแบบประเมิน IDSIQ (IDSIQ sleepiness domain score)
ในส่วนของความปลอดภัยจากการใช้ยา พบว่าทั้งสองงานวิจัยพบการเกิดอาการไม่พึงประสงค์ใกล้เคียงกัน โดยอาการที่พบตั้งแต่ร้อยละ 2 ขึ้นไป ในแต่ละกลุ่มทั้งที่ได้รับยาหรือยาหลอก ได้แก่ อาการหวัด ปวดศีรษะ อ่อนเพลีย วิงเวียนศีรษะ คลื่นไส้ และอาการง่วง ขณะที่อาการไม่พึงประสงค์ระดับรุนแรงไม่มีความแตกต่างกันระหว่างกลุ่มที่ได้รับยากับกลุ่มที่ได้รับยาหลอก
แหล่งอ้างอิง:
- Greb E. Newly approved drug improves sleep onset in insomnia[Internet]. 2022 [cited 2022 Feb 1]. Available from: https://www.medscape.com/viewarticle/967503#vp_1. Subscription required to view.
- Mignot E, Mayleben D, Fietze I, Leger D, Zammit G, Bassetti CLA, et al. Safety and efficacy of daridorexant in patients with insomnia disorder: results from two multicentre, randomized, double-blind, placebo-controlled, phase 3 trials. Lancet Neurol [Internet]. 2022 [cited 2 Feb 2022];21:125-39. Available from: https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(21)00436-1/fulltext. Subscription required to view.
- Janto K, Prichard JR, and Pusalavidyasagar S. An Update on Dual Orexin Receptor Antagonists and Their Potential Role in Insomnia Therapeutics. J Clin Sleep Med [Internet]. 2018 [cited 22 Sep 2022]. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6086961/.
- Monkemeyer N, Thomas SV, Hilleman DE, and Malesker MA. Insomnia Treatment Update With a Focus on Orexin Receptor Antagonists. US Pharm [Internet]. 2022 [cited 22 Sep 2022]. Available from: https://www.uspharmacist.com/article/insomnia-treatment-update-with-a-focus-on-orexin-receptor-antagonists.

